ISO 10993-1:2025는 의료기기 생물학적 안전성 평가의 핵심 기준이며,
규제기관 제출 자료의 신뢰도를 좌우하는 중요한 프레임워크입니다.
안녕하세요
와이즈컴퍼니(주)는 고객분들이 빠르게 변화하는 규제적 요구사항에 맞춰
대처할 수 있도록 도와드리고 있습니다.
와이즈컴퍼니는 ISO 10993-1:2025에 따른 생물학적 평가를 수행하고 있으며,
수행된 평가 보고서는 미국, 유럽, 국내 등 여러 규제기관에서 적절하게 사용되고 있습니다.
ISO 10993-1:2025 4.1항 Figure 2에서는 생물학적 평가 프로세스를 명시하고 있습니다.
해당 프로세스도는 기존 ISO 10993-1:2018 대비 더 명확하게 식별되었으며,
ISO 14971에 따른 위험관리 프레임워크를 적용하도록 자세히 기술하였습니다.
생물학적 평가 프로세스(ISO 10993-1:2025 Figure 2)
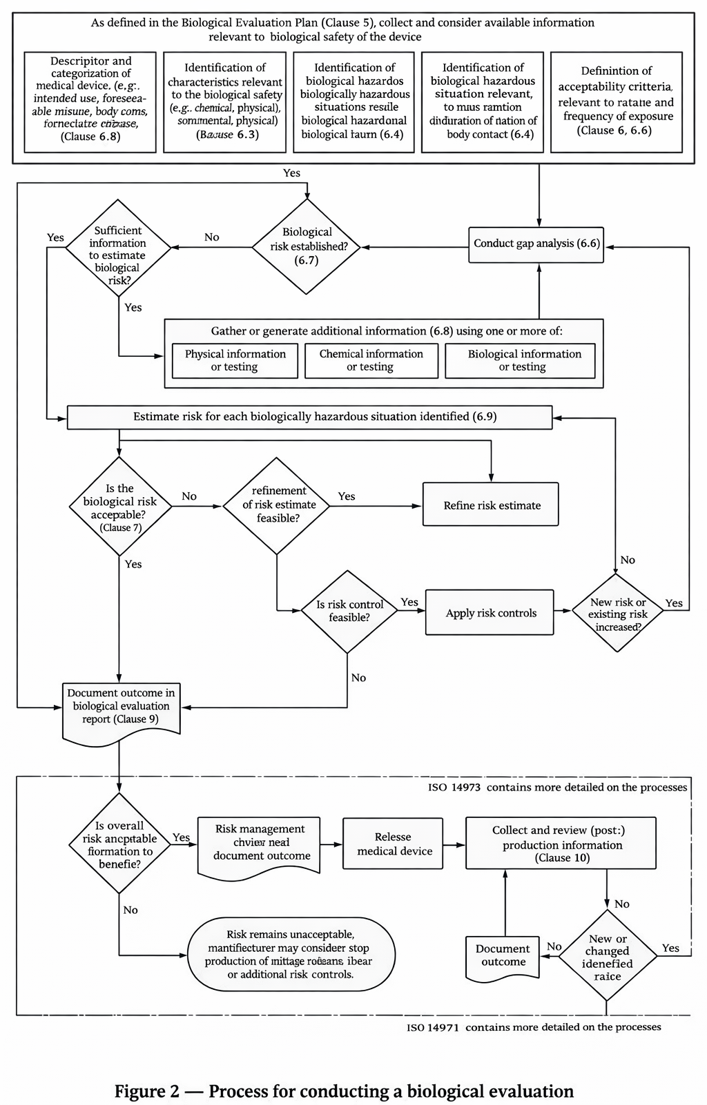
* 출처: ISO 10993-1:2025 (Figure 2)
이에 본 포스팅에서는 개정된 규격에서 명시하는 생물학적 평가 요구사항에 대해 설명드리고자 합니다.
ISO 10993-1:2025 생물학적 평가 요구사항
Biological evaluation (ISO 10993-1:2025)
01. 생물학적 평가 계획(BEP)에 포함해야 할 항목
Biological Evaluation Plan
생물학적 평가를 수행하기 위해 가장 먼저 필요한 것은 생물학적 평가 계획을 수립하는 것입니다.
본 문서는 의료기기의 생물학적 안전을 확보하기 위한 프로세스를 문서화하는 것이 목적이며, 아래 내용을 포함해야 합니다.
- 대상 기기에 대한 설명 (구성 재료, 제조공정 및 수명 주기 중 거치게 되는 기타공정(예, 멸균 또는 재처리) 포함)
- 사용목적
- 합리적으로 예측 가능한 오용
- 의료기기 분류 (접촉기간, 접촉 타입 등)
- 생물학적 안전에 관한 특성 식별
- 생물학적 위험, 위해상황 및 잠재적 위해 식별
- 생물학적 위험의 허용 기준
- 기존 데이터의 갭 분석
- 생물학적 평가 전략과 계획된 내용
- 전반적 생물학적 안전성 결론을 평가하기 위한 기준
- 특정 기술 역량이 필요한 생물학적 평가 측면 (예, 분석시험, 생물학적 시험 및 독성학 등)
- 생물학적 평가자
02. 생물학적 평가 보고서(BER)에 포함해야 할 항목
Biological Evaluation Report
- 의료기기 정보(의도한 적응증, 대상 환자군, 접촉 신체부위, 접촉 유형, 사용환경 및 작용원리 등)
- 사용목적
- 합리적으로 예측 가능한 오용의 잠재적 영향
-
수집된 데이터를 기반으로 수행된 위험 관리 기반 생물학적 평가
a. 생물학적 위험 분석b. 생물학적 위험 추정c. 생물학적 위험 평가d. 생물학적 위험 통제e. 잔여위험평가f. 생산 및 생산 후 활동
- 생물학적 안전에 대한 결과 및 결론
- 생물학적 평가자
03. 생물학적 평가는 언제 업데이트 되어야 하는가?
Lifecycle Update
생물학적 평가는 일회성이 아니라, 의료기기의 수명주기에 따라 지속적으로 업데이트 되어야 합니다.
따라서 기존 생물학적 평가에 의료기기의 생물학적 안전에 영향을 미칠 수 있는 차이가 있는지
검토하고 문서화 해야합니다.
생물학적 안전에 영향을 미칠 수 있는 차이의 예는 아래와 같습니다.
- 의료기기 설계 또는 사용방식의 변경
- 이전에 확인되지 않은 생물학적 위험의 발견
- 생물학적 위험의 추정치를 조정해야 하는 사용자 또는 환자의 피드백 혹은 다른 시판 후 정보
- 직/간접 접촉 물질의 사양 및 출처의 변경
- 의료기기 제형, 처리방법, 1차 포장, 멸균 등의 변경
- 보관에 대한 지침 및 기대치 변경
- 사용목적의 변경(접촉, 사용기간 또는 대상 환자군이 달라지는 변경)
💡 핵심 정리
ISO 10993-1:2025는 의료기기 생물학적 평가 프로세스를 보다 명확히 제시하고, ISO 14971 기반 위험관리 프레임워크와 연계하여 평가 계획(BEP)과 평가 보고서(BER)을 체계적으로 수립·유지하도록 요구합니다.
제조업체는 수명주기 전반에서 변경사항 및 시판 후 정보를 반영하여 생물학적 평가를 지속적으로 업데이트함으로써 생물학적 안전성과 규제 적합성을 유지해야 합니다.
이상으로 의료기기 생물학적 평가 안내드렸습니다.
감사합니다.
의료기기 생물학적 평가 관련하여 자세한 내용이 궁금하시다면
아래 연락처 또는 카카오톡 문의하기로 문의주시면
성심성의껏 답변하고 도움드리겠습니다.
같이 알아보면 좋은 정보
👇🏻 👇🏻 👇🏻
[시험인증] ISO 10993 생체적합성(생물학적 안전성) 시험
문의
의료기기 생물학적 평가(ISO 10993-1:2025) 관련 실무 적용 및 문서 작성이 필요하시다면
와이즈컴퍼니(주)와 함께 진행하세요.
아래 연락처 또는 카카오톡으로 문의주시면 성심껏 도와드리겠습니다.

와이즈 – 국내외 인허가 자문
와이즈컴퍼니(주) 카카오톡 문의하기


댓글 남기기