FDA 심사 준비, 걱정되시나요?
와이즈컴퍼니는 FDA 심사(실사)가 성공적으로 완료될 수 있도록 지원합니다.
이번 포스팅에서는 와이즈컴퍼니(주)가 수십 건의 프로젝트를 진행하며, 100% 성공률을 기록한 FDA QSR(품질시스템규정) 지도 및 심사 후기를 소개합니다.
FDA 심사 절차 및 진행 과정
FDA 실사는 아래 순서대로 진행됩니다.
- A. 심사 통보 (FDA Form 482)
- B. QSR 지도 및 심사 준비
- C. 심사 수행 및 발견 사항 (FDA Form 483)
- D. 보완
- E. 심사 종결 (EIR)
A. 심사 통보 (FDA Form 482)
FDA 심사원은 실사 일정 조율을 위해 먼저 이메일로 연락하며, 심사 대상 업체의 기본 정보와 관련 문서를 사전 확인합니다.
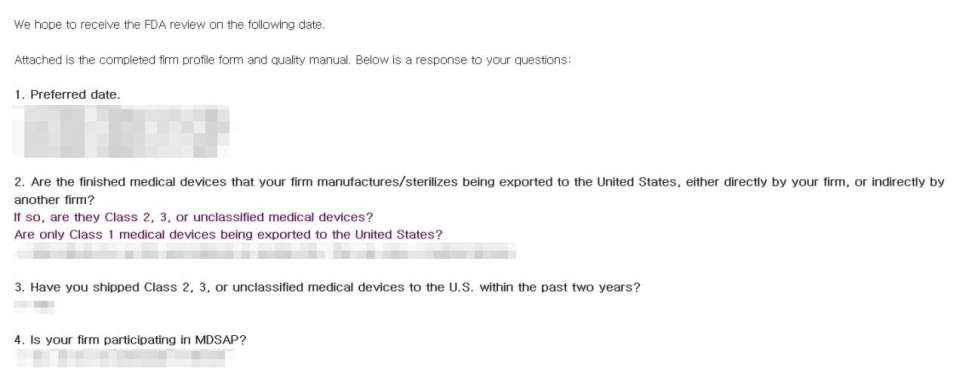
FDA 실사 시작 시 현장 책임자에게 수기로 전달되는
심사 통지서(Notice of Inspection)입니다.
심사관 정보, 업체 정보, 실사 목적, 법적 근거 등이 포함됩니다.
B. QSR 지도 및 심사 준비
와이즈컴퍼니는 총 3회(6일)의 현장 방문을 포함하여 고객사의 QSR 준수 여부를 체계적으로 지도합니다. 특히 510(k) 이후 변경 사항 관리가 매우 중요하며, 이를 놓칠 경우 실사에서 심각한 발견 사항으로 이어질 수 있습니다.
1) 의료기기 FDA QSR 교육 & 상태 점검
- QSR 심사 절차 및 주의사항 안내
- FDA 요구사항 교육
- 교육 자료 제공
- 시설 및 문서 현황 점검
- 연속 2일 방문 (총 1회)
2) 품질경영시스템 수립 지도
- FDA 요구사항 기반 생산현장 점검
- 품질경영시스템 세부 검토 및 개정
- 절차서·표준서 기반 기록 관리 지도
- 연속 2일 방문 (총 1회)
3) 사전 심사(Pre-audit)
- FDA 요구사항 기반 사전심사 수행
- 사전 심사 보고서 제공
- 시정 및 예방조치(CAPA) 지원
- 연속 2일 방문 (총 1회)
C. 심사 수행 및 발견 사항 (FDA Form 483)

FDA 심사원은 약속된 일정에 따라 심사를 진행하며, 발견 사항이 있을 경우 Form 483(관찰 보고서)를 발행합니다.
실사 종료 시 발견된 Observations를 기술한 공식 문서입니다.
기업은 15영업일 이내에 시정조치 계획 및 증빙자료를 FDA에 제출해야 합니다.
대응이 미흡하면 Warning Letter(경고장)이 발행될 수 있습니다.
D & E. 보완 및 심사 종결 (EIR)
와이즈컴퍼니는 Form 483 발견 사항에 대해 보완 계획 수립 → 답변서 작성 → 문서 정비 → 대응 전략까지 모든 과정을 밀착 지원합니다.
아래는 실제 FDA 심사 종결 시 발행된 EIR 예시이며,
본 사례는 Form 483 없이 “VAI(Voluntary Action Indicated)”로 종결되었습니다.
Establishment Inspection Report (EIR) 예시
보완 사항 및 난이도
아래는 실제 FDA QSR 심사에서 발견되었던 주요 Observation입니다.

#1 난이도: 보통
고객 불만 문서 관리 미흡
불만 조사 여부가 3건의 문서에서 명확히 문서화되지 않음.
#2 난이도: 쉬움
부적합 제품 처리 절차 미수립
부적합 수거·기록·폐기 절차 부재.
#3 난이도: 어려움
밸리데이션 미비
사후 검사만으로는 검증 불가한 공정의 밸리데이션이 수행되지 않음.
같이 알아보면 좋은 정보
마무리
이상으로 FDA QSR 지도 및 실사 후기였습니다.
와이즈컴퍼니는 단순 형식적 대응을 넘어,
FDA 실사 대응에 필요한 실질적 개선과 전략적인 문서 대응을 제공합니다.
문의
FDA QSR/QMSR 지도
와이즈컴퍼니와 함께 합리적으로 진행하세요.
아래 연락처 또는 카카오톡으로 문의주시면 성심껏 도와드리겠습니다.

와이즈 – 국내외 인허가 자문
와이즈컴퍼니(주) 카카오톡 문의하기


댓글 남기기